药用辅料系列之二——国内外药用辅料监管法规的比较
药用辅料质量的有效监管和控制离不开统一、完善的药用辅料国家标准体系。药用辅料标准根据起草颁布的单位、用途、法定地位的不同,主要可以分为国家药用辅料标准、地方药用辅料标准、药用辅料行业标准、药用辅料企业标准等类别,国家法定药用辅料标准主要由《中国药典》、部(局)颁标准、注册标准组成。
PART01.
药用辅料标准的分级管理
《总局关于药包材药用辅料与药品关联审评审批有关事项的公告》(2016年第134号),在公告中首次将药用辅料分级别,分为高风险、低风险药用辅料及不纳入关联审评的药用辅料,随后发布的文件也沿用此分类分级方法。
图片
图1 高风险药用辅料分类
与其他类别辅料相比,动物来源药用辅料存在一定特殊性,如原材料的易腐败性、易存在内源性残留物或外源性污染物(如:蛋白、微生物、病毒、农药、兽药等)、部分辅料的组成成分不完全明确或组成比例不确定等,从而可能会影响辅料质量的批间一致性 ,甚至引发不可预测的药品不良反应。
图片图2 动物来源药用辅料分类
PART02.
国内外药用辅料监管法规比较及特点
(一) 美国对药用辅料的监管
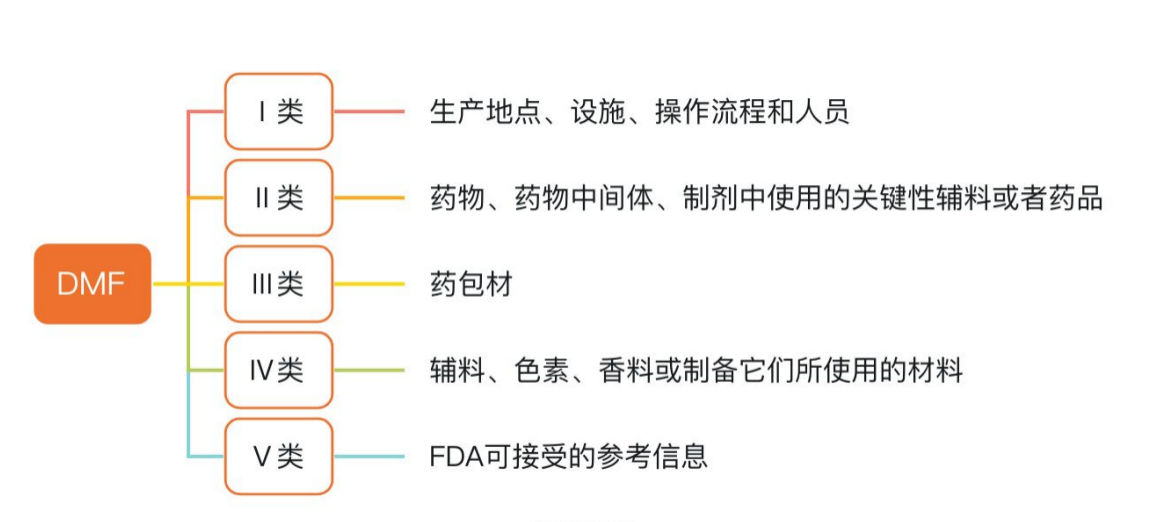
美国对药用辅料的采用DMF(Drug Master File, 药品主文件)管理制度,是一种为原辅包企业提供,向监管机构提交其机密信息以支持第三方药品申请人所提交申请的制度。根据内容,美国DMF分为以下五种类型,见图3.
图片
图3 美国DMF分类
美国除了采用DMF对辅料进行管理,还建立了药品生产登记制度和非活性成分数据库(IID)等配套措施,前者收载了生产者的生产场地和其生产的药品清单,这些信息可用于FDA进行上市后不良反应检测、现场核查、监测进口产品等监督,后者数据库包含了FDA已批准药品中使用的辅料信息,如名称、给药途径、化学物质登记号(CAS号)、唯一成分识别号(UNII)、最大用量等,以上信息有助于企业进行产品研发和监管者监管,DMF管理结合配套措施制度形成多方面多领域管理方式,极大提高管理效率。
(二) 欧洲对药用辅料的监管
欧洲药品质量管理局(EDQM)对药用辅料也进行了相应监管,包括《欧洲药典》专论的药用辅料适用性认证制度(CEP)和欧洲药物管档案(EDMF)备案两种方式。CEP证书只能处理《欧洲药典》收藏的物质,包括原料药和药用辅料,可控制用于药品的质量,我国的药用辅料也可申请CEP证书;而EDMF适用于除生物原料外的左右原料药,若该辅料已获得CEP证书,则在上市许可申请中辅料部分可以由CEP证书替代其相关资料;二是对于《欧洲药典》未收载的辅料,则与制剂一同进行审评。
(三) 日本对药用辅料的监管
为保护生产者的技术机密、使上市许可管理程序更加合理运行,日本在药用辅料的管理中引入MF登记制度(Master File System, 主文件制度)。当MF注册信息替换为正式的注册号(类似登记号)时,药品上市申请的科学审评才会启动。
(四) 国内对药用辅料的监管
我国药品监管部门对药用辅料的管理和质量越来越高度重视,逐渐建立了从现场核查、工艺控制到产品检验、标准完善的质量控制体系,采取了共同审评审批的科学监管模式,药用辅料行业得以较大程度的发展,年均发展速度达到10%以上,保障了药品研发的辅料可及性及整体质量的提高。在药用辅料方面,基于大分子小分子的分类方法,国产小分子药用辅料的质量状况良好,而大分子药用辅料的质量有待提高,尤其在功能性指标及批间稳定性方面,需加强与国外药用辅料的对比和一致性研究,为提高我国的药品质量服务。
在对制剂有效性中,应该加强对药用辅料关键质量属性的研究,通过对药用辅料功能性指标的建立、测定和评价以及功能性方法的建立、验证和评价,构建辅料功能性指标数据库,找出国产辅料和原研辅料在功能性指标上的差异,指导国内药用辅料企业和制剂企业实现从辅料选择随机化、处方设计经验化到辅料选择科学化、处方设计定量化质的飞跃,指导国内药用辅料企业切实提高国产辅料的质量,达到与原研质量一致。
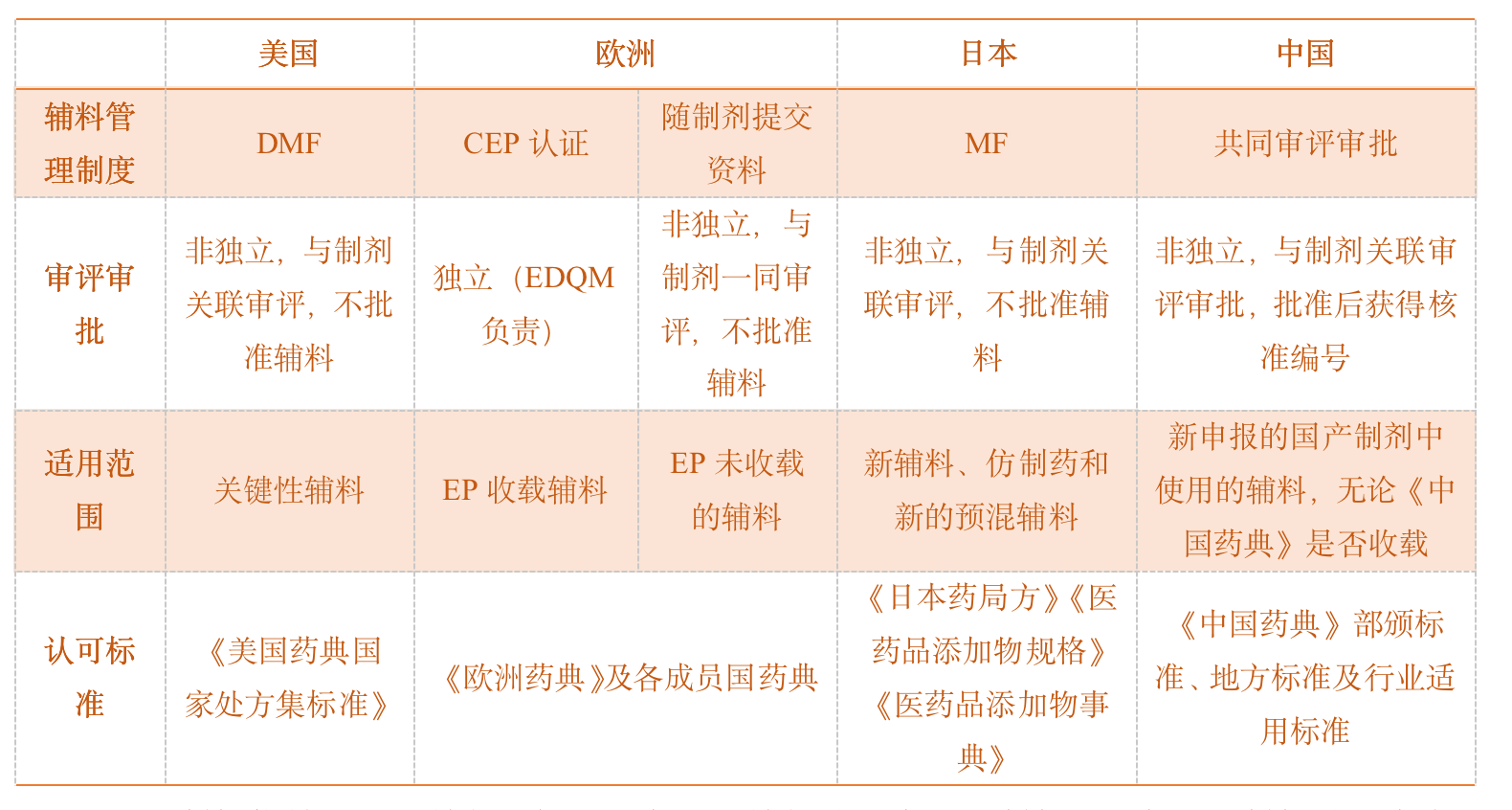
表1 不同国家辅料管理制度比较
图片
好的制剂依赖于好的辅料,如果没有好的辅料就没有好的制剂,没有好的制剂就没有安全有效的药品,药用辅料同药品质量和安全性息息相关,要使药物具有生物有效性、安全性、稳定性及适合不同的医疗要求均离不开科学辅料标准体系。
|
|




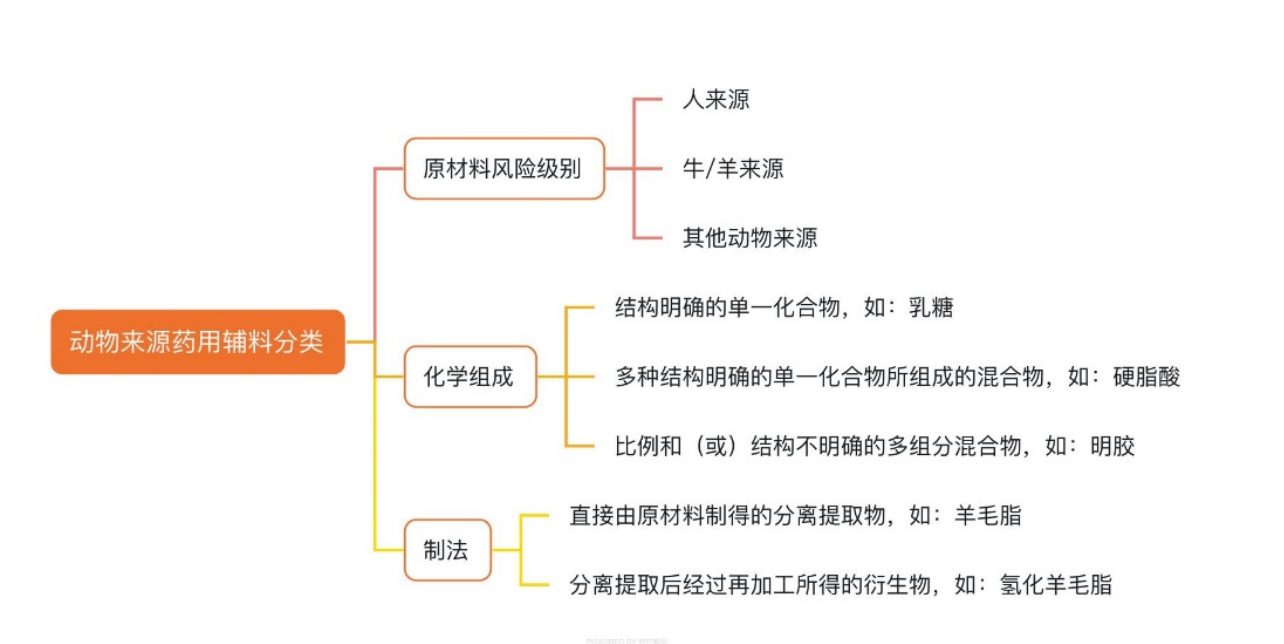 图2 动物来源药用辅料分类
图2 动物来源药用辅料分类